Исследователи из Северо-Западного университета США (Northwestern University) изменили последовательность ДНК бактериофагов и ввели ее внутрь синегнойных палочек (P. aeruginosa). Эти бактерии способны вызывать смертельно опасные инфекции и часто бывают устойчивы к антибиотикам. Попав в бактериальную клетку, искусственно сконструированная вирусная ДНК успешно обходит защитные механизмы, встраивается в хромосому и запускает конвейер по производству новых вирусных частиц. Они и уничтожают клетку – буквально взрывают ее изнутри.
Эта научная работа стала очередным шагом на пути к созданию так называемых дизайнерских вирусов, которые можно будет применять в качестве лекарств против устойчивых к антибиотикам бактерий. Параллельно такие исследования помогают лучше понять биологию фагов.
Результаты исследования были опубликованы в конце января 2024 года в журнале Microbiology Spectrum.
Руководитель исследования Эрика Хартманн отмечает:
Устойчивость [бактерий] к противомикробным препаратам иногда называют «тихой пандемией». Число инфекций и смертей от них растет по всему миру. Это огромная проблема. Фаговая терапия – недооцененная альтернатива антимикробным препаратам. Но во многих отношениях фаги являются «последним рубежом» микробиологии. Мы мало что о них знаем. Чем больше мы узнаём, как работают фаги, тем выше вероятность, что мы сможем разработать эффективные методы лечения. Наш проект является передовым в том смысле, что мы изучаем биологию фагов в режиме реального времени по мере их разработки.
Альтернатива антибиотикам жизненно необходима
В современном мире нарастает проблема антибиотикорезистентности: бактерии становятся всё более устойчивыми к препаратам. Из-за этого всё сложнее лечить многие инфекции. Например, Центры по контролю и профилактике заболеваний в США (CDC) сообщают, что в Америке ежегодно выявляется около 3 миллионов инфекций, вызванных устойчивыми микроорганизмами, и они уносят более 35 тысяч жизней.
Проблема усугубляется тем, что разработка новых антибиотиков давно застопорилась. Это заставляет ученых искать альтернативные методы лечения. В последние годы растет интерес к препаратам на основе бактериофагов.
В борьбе с опасными патогенами фаги показывают себя весьма неплохо, но с ними не всё так просто. Во-первых, эти вирусы очень избирательны: каждый бактериофаг может заражать только один вид бактерий или вообще только определенные штаммы в пределах вида. Во-вторых, к фагам бактерии тоже могут вырабатывать устойчивость. В-третьих, фаги – не просто лекарственные молекулы, а сложные биологические объекты. Их действие не всегда легко точно прогнозировать.
В целом, несмотря на то, что фаги – самые многочисленные существа на нашей планете (их около 1031), в знаниях о них пока есть масса пробелов.
Эрика Хартманн рассказывает:
На каждую бактерию приходится десяток соответствующих фагов. Таким образом, на Земле существует астрономическое число фагов, но мы изучили лишь немногие из них. У нас не было мотивации всех их серьезно изучать. Сейчас такая мотивация появилась, и мы увеличиваем число инструментов, с помощью которых можем их исследовать.
Лечение без побочных эффектов
Обычно, когда нужны фаги для борьбы с той или иной инфекцией, ученые отыскивают в окружающей среде подходящие вирусы и используют их как есть или определенным образом модифицируют. Бактериофаги уничтожают определенный вид бактерий, при этом не влияют на остальные, не нарушают микрофлору и не заражают клетки человека.
В перспективе можно было бы создать большой банк фагов, в котором будут храниться вирусы против разных возбудителей, и постоянно его пополнять. Выявив у пациента тех или иных возбудителей, врач мог бы запросить из банка нужные бактериофаги, а в больничной аптеке из них приготовили бы индивидуальное лекарство. Препараты, которые так делают, называются магистральными.
Ученые из Северо-Западного университета решили проверить, получится ли у них сконструировать фаги, которые будут эффективно уничтожать синегнойную палочку (P. aeruginosa). Это очень опасная бактерия, особенно для людей с ослабленной иммунной системой. P. aeruginosa часто вызывает внутрибольничные инфекции и отличается множественной лекарственной устойчивостью.
Искусственный вирус обошел защиту и уничтожил жертву
Процесс создания генно-инженерных фагов разделили на два этапа. Для создания синтетической ДНК использовали обычные пекарские дрожжи – Saccharomyces cerevisiae. Дело в том, что, в отличие от бактерий, в клетках грибка вирусные гены практически не экспрессируются и не влияют на свойства микроорганизмов. То есть заражение фагом как бы есть, но оно ни приводит ни к каким «симптомам» и последствиям. Это позволяет безопасно проводить обширные и самые разные модификации в вирусной ДНК.
Но дрожжи – не бактерии, и в них полноценные вирусные частицы синтезироваться не будут. Поэтому дальше нужно было «перезагрузить» новый бактериофаг. Для этого применили электропорацию: на бактериальные клетки P. aeruginosa подали высоковольтные электрические импульсы, проделали в них небольшие отверстия и ввели вирусный генетический материал. Фактически произошло то же самое, что и во время естественного заражения. Вирусная ДНК встроилась в бактериальную хромосому, и началось производство бактериофагов.
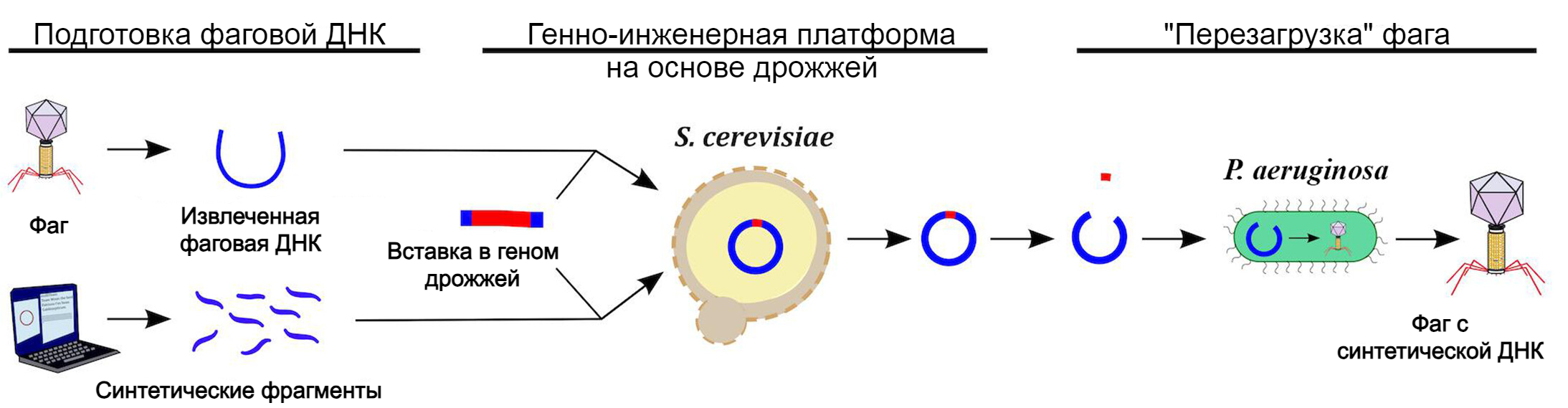
Некоторые бактерии смогли распознать и уничтожить вирусную ДНК. Тогда ученые оптимизировали процесс и вывели из строя защитные противовирусные механизмы.
После этого уже обкатанную методику испробовали на двух фагах, которые в диком виде вообще не способны заражать P. aeruginosa. И снова всё получилось.
Замечательное отличие фагов от других лекарственных препаратов в том, что они сами себя размножают. Когда зараженная бактерия погибает, наружу выходит множество новых вирусов, и они тоже отправляются на поиски жертв.
В целом технология выглядит весьма перспективной. Авторы этого исследования планируют продолжить работу. Пока только с фагами, заражающими P. aeruginosa, но постепенно, вероятно, доберутся и до других.