Консультативный совет FDA посчитал антиаритмический препарат компании Correvio небезопасным
Консультативный совет FDA проголосовал 11-ю голосами против 2-х за то, чтобы признать соотношение выгода/риск антиаритмического препарата Brinavess (vernakalant) канадской компании Correvio Pharma («Корревио Фарма») несоответствующим критериям, позволяющим рекомендовать его к одобрению, сообщает портал FirstWord Pharma.
Correvio стремится зарегистрировать данный препарат в США для быстрого купирования недавно возникшей фибрилляции предсердий у взрослых. Окончательное решение FDA ожидается к 24 декабря 2019 года.
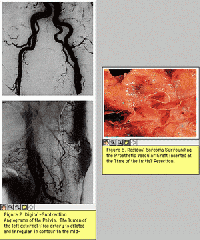
Члены Консультативного комитета отметили серьезные риски безопасности, включая гипотензию и нарушение ритма в нижних камерах сердца, а также летальные исходы пациентов в процессе клинических исследований (КИ). Это перекликается с проблемами, поднятыми в начале декабря в справке для служебного пользования FDA.
Впервые регистрационная заявка на Brinavess была подана в 2006 году компанией Astellas («Астеллас»). Тогда FDA приостановило КИ препарата в США в связи с проблемами безопасности после смерти одного пациента, получавшего vernakalant. Запрет на применение vernakalant в рамках КИ в США действует до сих пор, хотя FDA приняло повторную регистрационную заявку от Correvio в июле этого года. Тем временем, препарат был зарегистрирован в 41 стране (за исключением США), включая Канаду и европейские страны.
Компания Merck & Co. («Мерк энд Ко.»; за пределами США и Канады – MSD) была партнером Correvio (ранее – Cardiome Pharma) в разработке данного препарата в 2009 году и спустя несколько лет даже приобрела у Astellas права на vernakalant в Северной Америке. Однако Merck вернула компании Correvio глобальные права на препарат в 2012 году.